如您有相关FDA EUA授权认证办理,欢迎您直接来咨询我司工作人员,获得详细的费用报价与周期等信息,值得您的信赖与支持!
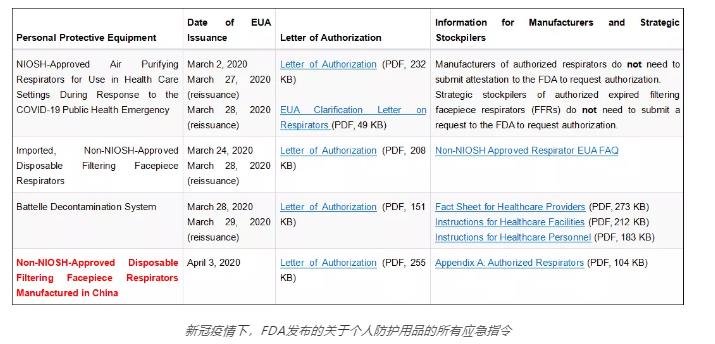
口罩出口美国新政策,中国标准获得FDA EUA授权。4月3日,美国FDA官网上专门发布针对中国生产的未获NIOSH认证的一次性过滤口置获得EUA授权的文件。

中国生产的口罩获得EUA授权的三个原则
1.由拥有-个或多个NIOSH认证产品的制造商,按照其他国家/地区的适用授权标准生产的其他型号的过滤式面罩呼吸器(FFR),FDA可以进行验证;
2.中国以外的其他地区授权的,FDA可以进行验证
3.有独立的测试实验室出具的检测报告,能显示其产品性能符合适用的测试标准的,FDA可以进行验证。
该条加注:如果符合这个原则,按照中国标准设计和验证的C置的制造商是可以获得EUA授权的

中国制造商电请材料提交清单
中国制造商可以根据这三个原则提交不同的申请材料,提交申请材料的清单如下:符合上述第一个原则,需提交:
1.NIOSH批准的呼吸器的制造商名称、型号和NIOSH批准号;
2.想要获得授权的呼吸器的制造商名称、地址、型号以及产品标签的副本;
3.预计在公共卫生紧急情况下进口的呼吸器的数量。
符合上述第二个原则,需提交:
1.想要获得授权的呼吸器的制造商名称、地址、型号以及产品标签的副本;
2其他监管机构或合格评定机构签发的市场销售授权文件/证书(包括授权号和合格评定机构的名称);
3.符合适用标准的证书;
4.预计在公共卫生紧急情况下进口的呼吸器的数量。
符合上述第三个原则的,需提交:
1.想要获得授权的呼吸器的制造商名称、地址、型号以及产品标签的副本;
2.测试机构的名称;
3.符合适用标准的证书;
4.测试报告显示其符合适用的性能标准;
5.预计在公共卫生紧急情况下进口的呼吸器数量。
中国制造商获得EUA授权的条件
A、经授权的口罩制造商须在其网站上用英文发布所有通过本EUA进口和授权的产品型号及其预期用途和其他说明。
B、制造商需将上述技术资料以及制造商名称、型号、预期用途、产品网站URL等以英文信件的方式整理,使之能发送到口罩用户终端场所(如医院)
C、制造商需要告知进口商关于此EUA的相关条款,且向进口商确定已按照条件B执行。
D、制造商需要建立不良事件上报FDA的通道。
E、疫情期间,制造商按照此EUA申请的口置的相关描述资料和术语(印刷版)应和CDC保持-致。
F、任何被该EUA授权的口罩,产品或技术资料上都不能明示或暗示该产品能有效预防COVID-19。
为便于FDA监管,生产商需保证产品所有的记录和存档文件在该EUA生效期间,FDA都能获得。
H、生产商不对其他任何附件功能或者条件负责,除非是同一制造商。
业务咨询:0755-27907896
统一客服热线:400 0199 838
联系人:蔡先生/刘小姐
地址:深圳市宝安区航城街道九围社区强荣东工业区E2栋2楼
讯科检测竭诚为您服务!



